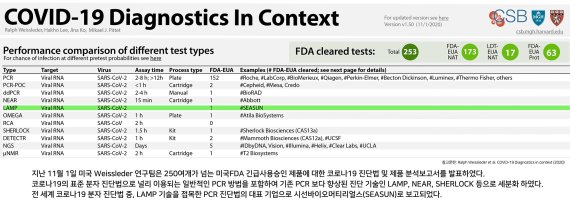
[파이낸셜뉴스] 시선바이오머티리얼스는 최근 코로나19 판별을 위한 분자진단용 시약인 '에이큐탑코비드19플러스'(AQ-TOP COVID-19 Rapid Detection Kit Plus)가 미국식품의약국(FDA)의 긴급사용승인에 이어 식품의약품안전처의 정식허가를 받았다고 24일 밝혔다.
이미 식약처 정식허가를 받은 '유탑코비드19플러스'(U-TOP COVID-19 Detection Kit Plus)에 이어 '에이큐탑플러스'까지 정식허가를 받음으로써 시선바이오는 코로나19에 대한 정밀진단과 신속진단 모두 가능한 통합진단 시스템을 완비하게 됐다.
시선바이오의 '에이큐탑플러스'는 사람의 면역반응으로 생성된 코로나 항체 또는 항원으로 검사하는 면역반응검사와 다르게 인체 내에 침입한 코로나 바이러스 유전자(SARS-CoV-2)를 직접 검출하는 분자진단법(PCR)으로 정확도와 신속성 두 마리 토끼를 모두 잡은 제품이다.
지난 10월 식약처의 정식허가를 받은 '유탑플러스'는 2중 유전자 지표를 사용하는 경쟁사와 달리 4중 유전자 지표를 사용함으로써 보다 정밀하게 코로나19 감염여부를 판별할 수 있는 PCR제품이다.
시선바이오는 보다 빠르고 정확한 코로나19 진단을 위해 검체 채취에서 결과 분석까지 모든 과정을 진행할 수 있는 원스탑플랫폼 구축을 완료하고 해외 수출에 주력하고 있다.
원스탑플랫폼은 코로나19 검사에 사용되는 모든 제품군을 하나의 패키지로 구성한 것이다. 패키지는 검체 채취와 운송을 위한 '탑바이러스컬렉션키트', 검체로부터 COVID-19 감염증 판별을 위한 SARS CoV-2 유전자 추출하는 '탑바이랄디엔에이/알엔에이엑스트렉션키트' 그리고 SARS CoV-2 유전자 유무를 확인해 감염여부 진단에 도움을 주는 분자진단키트로 구성돼 있다.
원스탑플랫폼의 모든 제품들은 국내 식약처 제조 승인을 완료했으며 탑바이러스컬렉션키트는 지난 9월 미국 식품의약국(FDA) 정식승인 후 현재 세계 각국으로 수출 중이다.
박희경 시선바이오 대표는 "원스탑플랫폼으로 코로나19 진단에 필요한 도구와 진단 시약을 패키지 공급이 가능하게 됐다"며 "앞으로는 대형병원은 물론 의료시설이 부족한 지역사회에서도 보다 빠르고 정확하게 코로나19 진단이 가능하게 될 것"이라고 밝혔다.
pompom@fnnews.com 정명진 기자
※ 저작권자 ⓒ 파이낸셜뉴스, 무단전재-재배포 금지