관련종목▶
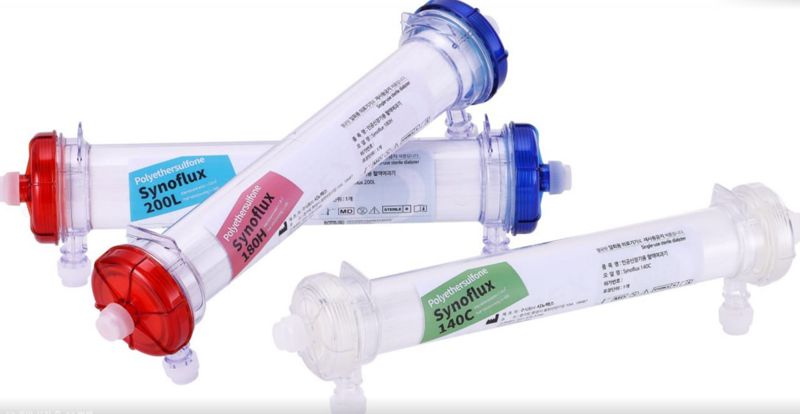
[파이낸셜뉴스] 시노펙스가 인공신장기용 혈액여과기(혈액투석필터)와 관련, 유럽 CE MDR 인증 조건인 임상시험윤리위원회(IRB) 승인을 위한 환자임상에 나선다.
26일 시노펙스에 따르면 부산 범일연세내과 등 3개 혈액투석 전문병원과 임상개시를 위한 협의를 마치고 유럽 CE MDR 인증 규정에 따른 환자 임상에 착수했다.
시노펙스는 지난해 10월 임상전문 'CRO(Contract Research Organization)' 업체인 케이에치메디케어와 계약을 체결했다. 그동안 해외 인증 요건에 맞춘 병원 확보와 각 병원의 IRB 승인 등 사전 준비를 마치고 이번에 환자 임상을 시작한다.
시노펙스 인공신장 사업본부 이진태 본부장은 "이번 임상은 새롭게 강화된 CE MDR 승인 규정에 맞춰 24명 환자를 대상으로 진행한다"며 "올해 상반기까지 환자임상을 마치고 하반기 중 임상 결과를 바탕으로 유럽 CE MDR 승인 신청과 국내외 학술대회에서 발표할 계획"이라고 말했다.
이어 "최근 서울대병원 등 5개 상급병원에서 진행한 50명 대상 공식 환자임상을 성공적으로 마무리한 것으로 미뤄볼 때 이번 임상도 좋은 결과를 예상한다"고 덧붙였다.
지난해 인공신장기용 혈액여과기 국내 식약처 인증을 획득한 시노펙스는 현재 국내 혈액투석 전문병원을 대상으로 제품 공급을 시작했다. 아울러 서울대병원 등 5개 상급병원 임상결과 논문 발표, 유럽 CE MDR 및 미국 FDA 인증 획득을 추진하며 해외 시장 진출도 준비 중이다.
한편 시노펙스는 이번에 임상을 진행하는 인공신장기용 혈액여과기 외에 △CRRT기기 △인공신장기(HD) △이동형정수기 △혈액회로 △혈액투석액 등 다양한 제품을 출시할 계획이다.
butter@fnnews.com 강경래 기자
※ 저작권자 ⓒ 파이낸셜뉴스, 무단전재-재배포 금지